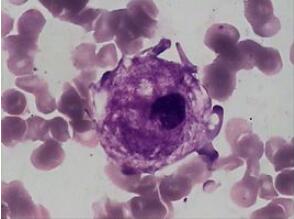
戈谢病于任何年龄自出生至80岁均可发病,但以少年儿童多发,7岁以下更多。可分为三型:
成人型(Ⅰ型)
为戈谢病最常见类型,也是脂质贮积病中常见者。犹太人(Ashkenazi-Jewish民族)中多见,但各民族中均有。在美国估计每年儿童患者不到5000例。任何年龄均可起病,常以脾脏大就医。进展可快可慢,进展慢者,脾脏大尤甚,有时有脾梗死或脾破裂而发生急腹症症状。肝脏呈进行性肿大,但不如脾脏肿大明显。病程久者,皮肤及黏膜呈茶黄色,常误诊为黄疸,暴露部位如颈、手及小腿最明显,呈棕黄色。眼球结膜上常有楔形睑裂斑,底在角膜边缘,尖指向内、外眦,初呈黄白色,后变为棕黄色。肺累及时可影响气体交换而出现症状。晚期患者四肢可有骨痛,甚而病理性骨折,以股骨下端最常见,也可累及股骨颈及脊柱骨。有脾功能亢进时可因血小板减少而有出血倾向。小儿戈谢病患者身高及体重常受影响。
婴儿型(Ⅱ型)
戈谢病患儿自生后即可有肝大、脾大,3~6个月时已很明显,有吸吮、吞咽困难,生长发育落后表现。神经系统症状突出,颈强直、头后仰、肌张力增高、角弓反张、踺反射亢进,最后变为软瘫,无反应。脑神经受累时可有内斜,面瘫等症状。易并发感染。由于病程短暂,多于婴儿期死亡,因此肝、脾脏肿大不如成人型明显,无皮肤色素沉着,骨骼改变不显著。
幼年型(Ⅲ型)
幼年型戈谢病常于2岁至青少年期发病,脾大常于体检时发现,一般呈中度肿大。病情进展缓慢,逐渐出现中枢神经系统症状,如:肌阵挛性抽搐、动作不协调、精神错乱,最后卧床不起。肝脏常轻微肿大,但也可进行性肿大而出现肝功能严重损害。
GD为常染色体隐性遗传性疾病。是由于β-葡糖苷酶-葡糖脑苷酯酶缺乏致葡糖脑苷脂在肝、脾、骨骼和中枢神经系统的单核巨噬细胞内蓄积。能导致疼痛、疲劳、黄疸、骨损伤、贫血甚至死亡。
戈谢病致病基因位于1号染色体。目前已经发现,许多不同的GBA点突变与发病有关。编码GC的基因位于常染色体1q21,基因长7kb,含有8个外显子。在此基因下游16kb处有一高度同源的假基因。GD患者可见到错义突变、剪接突变、转移突变、基因缺失、基因与假基因融合等。以错义突变最常见,导致GC的催化功能和稳定性下降。不同人种基因型的变异不同,如犹太人群体中N370S最常见,仅见于Ⅰ型患者,纯合子病情轻。而在亚洲人群中则无这种变异型。GD患者中已确定的基因突变有100余种,中国人GD的基因型已报道10例,其中5例Ⅰ型为G46E/L444P,F37V/L444P,N188S/L444P、Y205S/L444P及R48W/R120W;2例Ⅱ型均为F213I/L444P;3例Ⅲ型为N409H/N409H,G202R/N409H及L444P/L444P,其中以L444P基因型最常见,在等位基因中占领40%,并出现在各型GD中。L444P在Ⅰ、Ⅱ和Ⅲ型患者中均可见到纯合子病情重,常有神经系统症状。F37V及Y205C为中国人特有的新生突变。
戈谢病合并脾脏改变主要与一下疾病相鉴别:
1. 尼曼-皮克病(鞘磷脂贮积症)见于婴儿且肝脾也肿大但此病肝大比脾大明显;中枢神经系统症状不如戈谢病显著。主要鉴别点为此病黄斑部有樱桃红色斑点骨髓中所见特殊细胞与戈谢病显著不同,血细胞化学染色检查时,戈谢病过碘酸雪夫反应为强阳性,尼曼-匹克病为弱阳性。
2. 某些代谢性疾病如脂质贮积病中的GM1神经节苷脂贮积症,岩藻糖苷贮积症及黏多糖贮积症IH型(Hurler综合征),均有肝大脾大及神经系统表现,但GM1神经节苷脂贮积症50%,有黄斑部樱桃红色斑骨髓中有泡沫细胞,三者均有丑陋面容、舌大心脏肥大,X射线片均有多发性骨发育不良改变岩藻糖苷贮积症尚有皮肤增厚及呼吸困难等
3. 具有肝脾肿大的疾病如血液病中的白血病霍奇金病汉-许-克病(Hand-Schüller-Christiandisease)重型珠蛋白生成障碍性贫血,鉴别一般不困难汉-许-克病除肝大脾大外尚有骨骼缺损及(或)突眼及(或)尿崩症另外尚应与黑热病及血吸虫病鉴别。
4. 具有戈谢细胞的疾病戈谢细胞可见于慢性粒细胞白血病、重型珠蛋白生成障碍性贫血、慢性淋巴细胞白血病此类患者中β-葡糖脑苷脂酶正常但由于白细胞太多如慢性粒细胞白血病中神经鞘脂的日转换率为正常的5~10倍;重型珠蛋白生成障碍性贫血时,红细胞的神经鞘脂转换率也增加超越组织巨噬系统的分解代谢能力,而出现葡糖脑苷脂的沉积形成戈谢细胞艾滋病及分枝杆菌属感染及霍奇金病时也可有戈谢细胞。鉴别有赖于临床、辅助检查及β-葡糖脑苷脂酶的测定。
5.有时在骨髓中看到一种与戈谢细胞很相似的假戈谢细胞(pseudogaucher’scell)它可出现在慢性粒细胞白血病、地中海贫血、多发性骨髓瘤、霍奇金淋巴瘤、浆细胞样淋巴瘤(plasmocytoidlymphoma)及慢性髓性白血病它与戈谢细胞的不同点是胞质中无典型的管样结构。鉴别诊断时可做酶学活性测定。
一、一般疗法
注意营养,预防继发感染。
二、对症治疗
贫血或出血多的戈谢病患者可予成分输血、巨脾或脾功能亢进症状明显者,可考虑切脾,但全脾切除后虽可减轻腹部负担,减轻贫血和出血倾向,改善发育状态,偶可自行缓解而痊愈,但有加速肝大及骨骼破坏的可能。故应尽量延迟手术,必要时,可考虑部分脾切除术。骨痛可用肾上腺皮质激素。
三、 酶疗法
国外近年来采用β-葡糖脑苷脂酶治疗戈谢病,取得一定疗效。成人型治疗1年后一般情况好转,肝脾明显缩小,生长发育加快,血红蛋白升高,血小板亦缓慢上升,肺部受累者,肺功能亦可得到改善。骨病变如旧,但发现治疗初期有不伴尿钙增加的低血钙情况,推测骨病变好转可能需较长时间。婴儿型应用后,肝、脾可缩小,但脑症状多不能好转。目前对应用剂量及方法尚不统一,初步应用结果认为2.3U/kg,每周3次,静脉滴注,疗效与60U/kg,每2周1次疗效相似。此提示2周1次的大剂量方法非常不经济,前种方法可降低极为昂贵的药费。婴儿型的剂量一般认为应较大,每月70~120U/kg,每周2或3次。此酶的来源有2种:一为来自胎盘名阿糖脑苷酶(alglucerase)或β-葡萄脑苷酯酶(ceredase),另一为重组品,名imiglucerase或cerezyme,各15例双盲法比较,疗效相仿。
四、骨髓移植
异基因骨髓移植治疗能使酶活力上升,肝、脾缩小,戈谢细胞减少,但手术危险性与疗效必须慎重衡量考虑。
五、基因治疗
已试用β-葡糖脑苷脂酶的正常基因插入到自身干细胞中并进行自身移植,尚需进行继续研究。
遗传性代谢性疾病产前诊断(antenatal diagnosis of hereditary metabolic disease)是防止遗传病发生的有效措施之一,是人类遗传学知识的实际应用,是优生的重要措施。戈谢病确定患儿基因型后,其母再次妊娠可做产前基因诊断,也可予杂合子检查。
羊膜腔穿刺术(amniocentesis)可于妊娠中期17~20周通过腹壁进行,羊水细胞是胎儿脱落的上皮细胞,经培养后可做酶活性测定或基因分析。此方法造成的胎儿丢失率为0.5%。至今仍然是产前诊断的一个重要手段。
绒毛来自胚胎滋养层,可于妊娠10~12周,通过腹壁吸取绒毛。可用于酶活性测定或基因分析。优点是比羊膜腔穿刺提前了2个月,不必培养,可较早获得产前诊断结果。一旦胎儿患病,孕妇可及时选择人工流产,后续操作比较容易进行,而且可早日解除孕妇的心理负担。
产前诊断的先决条件是对先证者做出准确的诊断,母亲再次妊娠时才可能在产前诊断时有目的地查某种酶或某种基因检测。尤其产前基因诊断,除了缺失和用PCR/ASO方法能直接检测出基因缺陷外,其他连锁分析方法都以临床诊断为前提。原因就是某些遗传病存在遗传异质性,同样的疾病表型可由多个基因座突变引起,例如肌营养不良症,较常见的是DMD/BMD,但还有其他基因突变可导致肌营养不良。如果临床诊断不准确,用A病的多态性位点进行B病的基因诊断,势必被引入歧途,导致诊断错误。其次还要避免样品污染,胎儿材料中母源DNA的污染不容忽视。血性羊水常是导致诊断错误的根源之一,严重的血性羊水一定要通过培养去除孕妇的白细胞。绒毛采集后,一定要在倒置显微镜下检查挑选,剔除子宫内膜组织。
在产前清楚判明胎儿是否患病,有的还可在孕早期做出产前诊断,在优生上具有“预防”的意义。因可在临床上根据明确的产前诊断结果阻止胎儿出生,它不仅是惟一可行的优生措施,而且能减轻家庭及社会的负担,提高人口素质。
目前,我国对罕见病仍然没有官方的权威定义,疾病种类与患病人群的数据也没有确切报道。在罕见病防治救助方面的工作进展缓慢,对罕见病药品的研发、引进、生产、销售等环节缺少政策支持,造成国内罕见病药品研制产业存在空白。我国也尚未为罕见病建立任何医疗报销制度,只有极个别的罕见病能获得极其有限的慈善资助。
医学教授表示,在目前已经确认的五千多种罕见病中,只有约1%是可以治疗的,绝大部分都是无药可治。但是这1%的罕见病药价钱确实昂贵,在没有任何医疗报销制度的帮助下,很少家庭能承担这个费用,而在美国、欧盟等国则加大了罕见病药的相关法律保障。罗学群教授举例“在美国,戈谢病患者只需每年支付1000美元的保险费,就可以免费使用治疗药物,所有费用由保险公司承担。” 罗教授希望我国对于罕见病诊治的基础研究能制定相应的倾斜资助措施,并将逐步提高对罕见病患者医疗保障和社会救助水平。
电话全程免费,可以放心接听!
预约咨询


微信扫一扫
400-080-8850